发布时间:2024-10-22点击: 次
一、机构药房基本信息
1、地址:广西南宁市双拥路6号广西医科大学第一附属医院5号楼(儿科)负一楼
2、联系电话:0771-5356013
3、机构药房邮箱:gxykdyfy_jgyf@126.com
4、药品管理员:兰老师 13036887535(微信同号)
苏老师13557010574(微信同号)
5、工作时间和相关要求
(1)工作时间:周一至周五8:00-12:00和15:00-18:00,周末和节假日不上班,如有特殊情况需提前与药品管理员进行沟通确认。
(2)为提高试验用药品管理效能,申办方应根据试验进展寄送合理的药品数量(例如:首次寄送只需备2例受试者一个周期用药量,后续按试验和进展寄送药品数量)。
二、 试验用药品接收
1、接收时间:每周固定2天(周一和周四)8:00-12:00和15:00-18:00
2、前期工作:
(1)接收预约:需提前1周扫码在线填写药品接收预约表(如图1);若有随机系统请在预约表附上链接;未提前填写预约表或未按预约表上的时间送达的药品不予接收!
(2)填写接收预约表成功后,扫描页面答卷填写凭证二维码获取“预约配送编号”(如图2.图3);药品配送时在配送单上标注该编号,药品管理员接收药品时将根据该编号与预约信息核对,若无编号的药品不予接收或退回至申办方。

图1.药品接收预约表
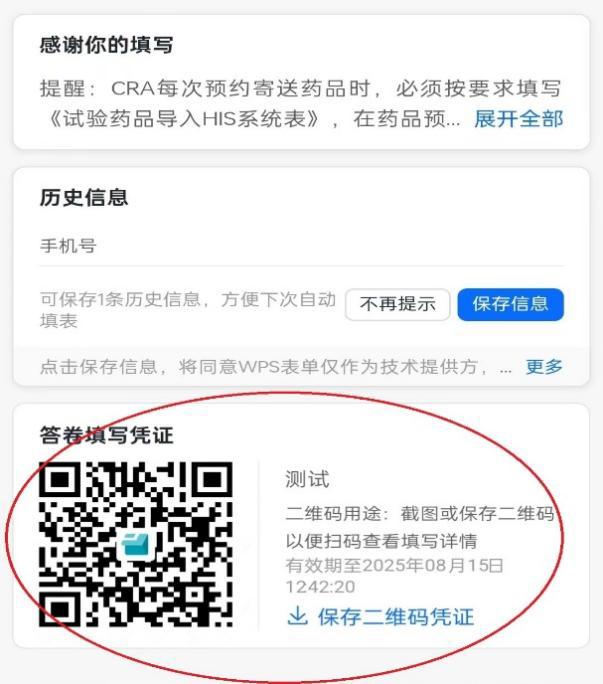
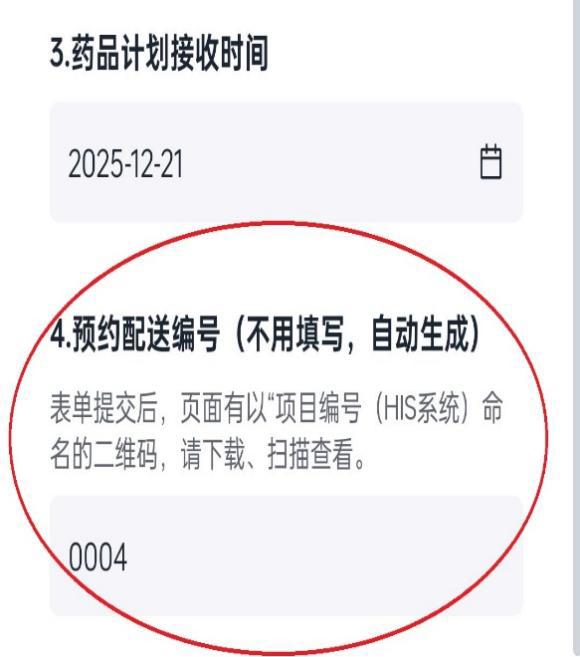
图2.下载凭证二维码 图3.获取“预约配送编号”
(3)试验药品接收与发放登记表填写及时限要求
①接收药品前CRA按要求填写《试验药品接收与发放登记表》;《试验药品接收与发放登记表》可扫码机构办文档表格网盘获取(如图4)。

图4.
②到药后,CRA/CRC须打印本次到药的《试验药品接收与发放登记表》交到机构药房,由药品管理员审核后完成入库,本周到的药品登记表必须在本周五前提交到药房审核。若登记表未按规定时间提交至药房审核,药品将退回至申办方。
2、药品寄送要求
(1)随箱资料必须包括:①药检报告;②温度计校准证书;③药品清单/接收单;④物流单;
(2)机构药品管理员接收时负责清点、检查药品、并打印运输过程温度监控;
(3)运输过程中发生超温事件,原则上退回至申办方。
三、试验剩余药品和空包装回收
回收时间为每周周二和周五16:00—17:30;其他时间不办理回收的相关事宜!
 返回顶部
返回顶部